Retinaya Büyük Gen Fragmentinin Aktarılmasında AAV Vektörlerinin Kullanımı
AAV vektörleri, çoğu kalıtımsal retinal hastalıkların tedavisi için sıklıkla kullanılan bir araçtır.
Özet:
• AAV vektörleri, çoğu kalıtımsal retinal hastalıkların tedavisi için sıklıkla kullanılan bir araçtır.
• AAV vektörü kullanılarak hem fotoreseptörlere hem de retinal pigment epiteline teröpatik genlerin aktarımı yüksek güvenli ve etkili sağlanabilir.
• AAV vektörlerinin paketleme kapasitelerinin sınırlı olması (5 kb’dan büyük genleri taşıyamaması), mutasyon içeren bölgeye hedef teröpatik genin aktarımında sorun oluşturabilir.
• Bu makalede AAV vektörlerinin büyük kapasiteli fragmentlerin taşımasını sağlayacak yöntemlerin geliştirilmesi üzerinde uygulanan yöntemlerden bahsedilmiştir. Bu uygulamalarla boyutu 5kb’dan büyük gen dizisine sahip mutasyonlu genlerin tedavisi gerçekleştirilebilir.
Giriş:
Göz; küçük olması, örtülü yapıya sahip olması, kolay erişilebilir olması nedeniyle gen terapi uygulaması için ideal bir hedeftir.
Gen terapi araçlarının gelişmesi ve kullanımının artması ile kalıtsal retinal hastalıkları üzerinde yapılan gen terapi uygulamaları artış göstermiştir.
Luxturna vektörü, kalıtsal retinal hastalıkların tedavisi için kullanılan ilk AAV vektördür. İlk olarak ABD’de onaylanan terapi daha sonra tüm Avrupa’da kabul edilmiştir.
Rekombinant Luxturna vektörü retinal gen iletimi için yaygın olarak kullanılmaya başlanmıştır.
AAV’lerin Özellikleri:
• Parvoviridae ailesinin bir üyesi olan AAV’ler 25 nm boyutunda, zarfsız ve ikosohedral yapıdadırlar.
• ~4.7 kb uzunluğunda lineer ssDNA’ya sahiplerdir. ssDNA’sının her iki ucunda 145 bp’lık palindromik ITR (Inverted Terminal Repeat) dizileri bulunur.
• ITR dizileri zincir sonunda hairpin benzeri 2˚ yapılar oluşturur. Bu yapılar rekombinant AAV genomundaki cis’te tutulan tek viral dizilerdir.
• AAV tabanlı vektörler, güvenirliliğinin yüksek olması ve düşük immün cevaba neden olması nedeniyle gen terapisi alanında kullanımında hız kazanmıştır.
• Şu ana kadar tanımlanan kendine has özellikleri olan birçok AAV alt tipi mevcuttur. Bu durum retinal hastalıklar için gen terapi aracı olarak kullanılacak vektör çeşitliliğinin artmasını sağlamıştır.
• Gen terapi aracı olarak ilgili retinal hücre yüzeyine uyum sağlayacak en uygun AAV serotipinin seçilimi yapılır.
• Kalıtımsal olarak mutasyonlu gen dizisi içeren retinal hücrelere, farklı AAV vektörleri ile gen aktarımının yapılması sonucunda AAV5, AAV7, AAV8 ve AAV9 serotiplerinin fotoreseptörlerde etkili şekilde uyum sağladığı gözlenmiştir.
• AAV’lerin haricinde kullanılan viral ve viral olmayan gen terapi araçlarında AAV tabanlı vektörlerde görüldüğü gibi fotoreseptörlere yüksek uyum gözlenmemiştir.
• AAV tabanlı bir gen terapi aracının paketleme kapasitesinin 5 kb olması gen terapi uygulaması için bir sınır oluşturur. Bir AAV tabanlı vektörde minimal olarak; aktarılmak istenen teröpatik genin CDS (Coding Sequencing)’sinin, ITR dizilerinin, promoter dizisinin ve poliA sinyal dizisinin bulunması gereklidir.
• Bu sınırlandırma nedeniyle 4 kb’dan büyük bir retinal gende meydana gelen mutasyonun tedavisi AAV tabanlı vektör ile gerçekleştirilememektedir.
Büyük Gen Aktarımları İçin Uygulanan Stratejiler
Temel olarak 2 yöntem uygulanabilir:
1. Oversized AAV Vektörler: 5 kb’dan büyük insert eklenmesi ile oversized AAV vektörlerinin oluşturulması (forced packaging) ile gen aktarımının sağlanması
2. İkili AAV Vektörleri: İki AAV vektörüne büyük insertün parçaları eklenerek gen aktarımının sağlanması. Bu yöntemde iki parça hedef hücreye aktarıldıktan sonra hücresel mekanizmalar ile düzenlenerek tek bir parça haline getirilir.
Oversized AAV Vektörleri:
Bazı araştırma grupları bir AAV vektörüne büyük bir genin aktarılması ile in vitro ve kalıtsal retina hastalık modellerinin retinalarında ilgili proteinin ekspresyonu ile hücrede gözlenebilir bir gelişmenin olduğu bulunmuştur.
Tek bir parça olarak vektöre aktarılan DNA parçasının sadece ilgili gen dizisine ait bölümler içermediği, farklı bölgelerin de vektöre klonlandığı gözlenmiştir. Bu durumun ortadan kaldırılması için parçalı olarak vektörlere aktarımı sağlayan ve hücrede birleştirilerek tek parça haline gelen bir yöntem (dual AAV vektörleri)oluşturulmuştur.
Oversized vektörlerle yapılan bazı çalışmalarda bazı genlerin sadece bu vektör kullanımında yüksek ekspresyon gösterdiği; bazı genlerin ise dual AAV’ler kullanıldığında yüksek anlatım gösterdiği gözlenmiştir.
İkili AAV Vektörleri
Bu yöntemde aynı hücreye iki ayrı AAV tabanlı vektör ile gen aktarımı yapılır. Büyük boyutlarda olan genler iki vektöre klonlanacak şekilde iki parçaya ayrılır ve klonlama gerçekleştirilir. Ardından aynı hedef hücreye aktarımları sağlandıktan sonra ilgili gen parçaları arasında meydana gelen rekombinasyon ile tek ve uzun fragment oluşumu sağlanır.
Bu yöntemle aktarılan insert boyutu iki katına çıkarılarak maksimum ~9 kb uzunlupundaki genin aktarımı sağlanabilir.
İkili AAV vektör oluşumu 3 farklı strateji ile sağlanabilir:
1. Trans-Splicing İkili Vektör Stratejisi
2. Overlapping (Örtüşen/Çakışan) İkili Vektör Stratejisi
3. Hibrid Vektör Stratejisi
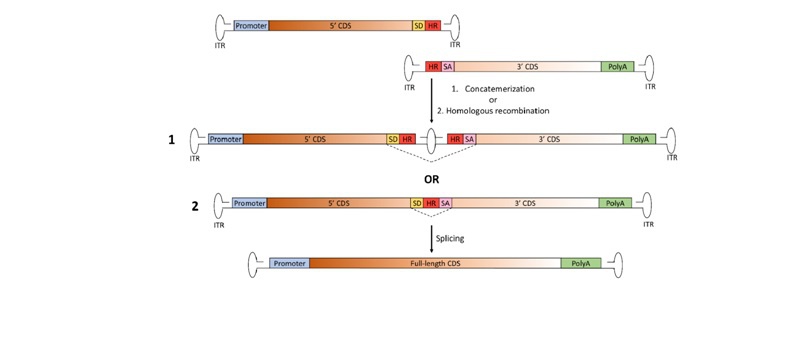
a. Trans-Splicing İkili Vektör Stratejisi
Bu yaklaşımda tam uzunluktaki genomu yeniden oluşturmak için AAV genomunun uçlarında bulunan ITR dizilerinin doğal olarak birleşme yetenekleri rol oynar.
Kullanılan her iki vektör transgenin iki ayrı yarısını taşır. Bu diziler birbiri üzerine örtüşecek diziler (overlap) içermez.
Transgenin 5’ kısmını taşıyan vektörün AAV genomunun 3’ ucunda SD (Splice Donor) sinyali bulunurken transgenin diğer yarısını taşıyan vektörün AAV genomunun 5’ucunda SA (Splice Acceptor) sinyali bulunur.
Bu iki sinyal dizisi, transgen parçalarının hücreye aktarımından sonra etkileşerek tek ve uzun fragment (konkatemerik yapı) oluşumunu sağlar.

1: Trans-Spilicing İkili Vektör Birleşimi
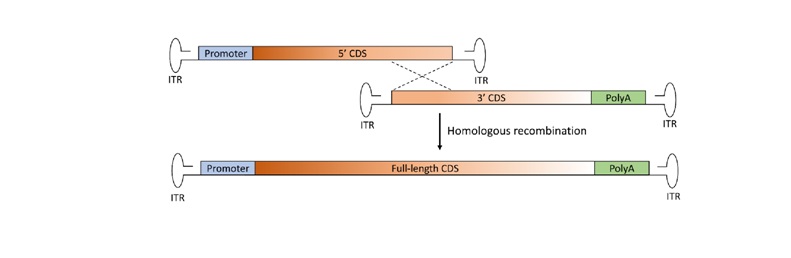
b. Çakışan İkili Vektör Stratejisi
Bu yöntemde transgen, homolog çakışan sekanslar paylaşan iki parçaya bölünür. Hücreye gen parçalarının aktarımından sonra transgenin tekrar birleştirilmesi homolog rekombinasyonla sağlanır.
Bu birleştirme stratejisi diğer uygulamalarla karşılaştırıldığında tasarımsal olarak daha basittir ve daha az yabancı ya da yapay DNA elementine ihtiyaç duyulur.
Homolog rekombinasyonla konkatemerik yapının oluşumunun sağlanması için CDS’lerde homolog rekombinasyona aracılık eden bölgelerin olması gereklidir.
Bu yöntem kullanılarak retina hücrelerine aktarıla genin fonksiyonel olarak istenilen düzeyde olması retinal hücre tipine göre değişiklik gösterir. İki parça olarak aktarılan transgenin homolog rekombşnasyonla birleştirilmesi hücredeki rekombinasyon sistemi tarafından gerçekleştiğinden her hücre tipinde birleşme sağlanmayabilir.
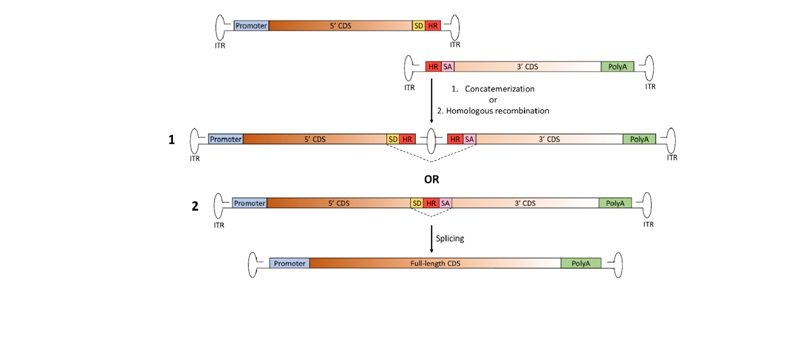
c. Hibrid Vektör Stratejisi
Bu yöntem diğer iki yöntemde gözlenen sorunların giderilmesi için geliştirilmiştir.
Bu yaklaşım, hücreye aktarılan iki parça halindeki transgenin yeniden birleştirme verimliliğini arttırmak için birden fazla birleştirici sinyalin kullanılmasına dayanır. Vektörün AAV genomunun uçlarına eklenen SA-AS sinyal dizilerinin dışında rekombinasyonu sağlayan dizilerin eklenmesiyle hibrid vekötrler oluşturulur.
Rekombinasyon dizileri; transgenin 5’ ucunu içeren vekötörde SD sinyali ile ITR dizisi arasına, transgenin 3’ ucunu içeren vekötörde ITR ve SA sinyalinin arasına eklenir. Yeniden birleşen transgenin transkripsiyonu sonrasında splicing işlemi ile bu sinyal dizilerinin çıkarılması sağlanır ve fonksiyonel gen ürünü oluşur.
Bu yöntem diğer iki yöntemden daha etkili olup hücre içinde SA-AS sinyal dizisi ya da homolog rekombinasyon aracılığıyla düzenlenmesi sağlanır.
Rekombinasyon dizileri; transgenin 5’ ucunu içeren vekötörde SD sinyali ile ITR dizisi arasına, transgenin 3’ ucunu içeren vekötörde ITR ve SA sinyalinin arasına eklenir. Yeniden birleşen transgenin transkripsiyonu sonrasında splicing işlemi ile bu sinyal dizilerinin çıkarılması sağlanır ve fonksiyonel gen ürünü oluşur.
Bu yöntem diğer iki yöntemden daha etkili olup hücre içinde SA-AS sinyal dizisi ya da homolog rekombinasyon aracılığıyla düzenlenmesi sağlanır.
Çeviren ve Düzenleyen: Merve Gül TURAN
Kaynak: Trapani I. Adeno-Associated Viral Vectors as a Tool for Large Gene Delivery to the Retina, Genes, 2019
Genetik Haberleri
-
Bugün 16 Nisan Dünya Biyologlar Günü!
-
Allopatrik türleşme nedir ? Nasıl Gelişir ?
-
Maryland’teki “Kölelerin” Yaşayan 42.000 Akrabası Bulundu
-
Araştırmacılar kediler, yunuslar, kuşlar ve düzinelerce başka hayvanın genom haritasını çıkarıyor
-
Kolombiya'da nadir görülen bir kuş türünde "gynandromorphy" gözlemlendi
-
Kurumaya dayanıklı bitkiler için genom veritabanı yayınlandı
-
En son DNA barkodlama teknolojisiyle İsrail'in tatlı su balık türleri listesinin yeniden gözden geçirilmesi
-
İnsanların Daha Önce Bilinmeyen Bir Dokunma Duyusu Keşfedildi
-
Bilim İnsanları Tüm İnsan Genomunun Dizilimini Çıkardı. Ancak Henüz Bitmedi
-
İlk Defa Tazmanya Kaplanından RNA Elde Edildi
-
Neandertal DNA’nız, Sizi Acıya Karşı Daha Hassas Yapıyor Olabilir
-
Epigenetik ve Epigenetik Mekanizmalar
-
İlk taslaktan 20 yıl sonra insan Y kromozomu tamamen dizilendi.
-
Kim Bu Kimerizm? Tek Bedende İki Kişi
-
Gen terapi, genetik materyalin yeniden düzenlenmesi